Sergio Castro, Gerente General – Castro Ingeniería

Introducción
El objetivo de esta Newsletter es analizar los avances más recientes en la tecnología de lixiviación de minerales de Cu primarios, bajo el concepto de lixiviación catalítica.
Se anticipa que, entender el rol de los catalizadores resultará fundamental para el desarrollo de nuevas tecnologías de lixiviación de calcopirita a escala industrial.
Dentro de este contexto, la lixiviación yodurada, es un claro ejemplo de lixiviación catalítica de calcopirita, donde el ion yoduro (I⁻) actúa como catalizador en medio Fe³⁺/H₂SO₄, aumentando la velocidad de extracción de Cu.
Este efecto cinético puede reducir significativamente la duración del ciclo de lixiviación.
Lixiviación sulfúrica de calcopirita
La revisión de antecedentes, permite concluir que la principal reacción de lixiviación sulfúrica de calcopirita (CuFeS₂) es de cinética lenta, debido a la alta energía de la red cristalina de la calcopirita, y a la formación de una capa de pasivación sobre su superficie (capa compacta formada por azufre elemental y/o poli-sulfuros). Este comportamiento ha sido la mayor limitación para lixiviar minerales de Cu primarios.
Teóricamente, el mecanismo se interpreta como una reacción química heterogénea (sólido/solución), que obedece al modelo de núcleo recesivo.
Sin embargo, el efecto del ion yoduro sugiere un mecanismo distinto, haciendo plausible su clasificación como una reacción electro-catalítica, por lo cual, su cinética puede ser aumentada mediante catalizadores redox.
Es relevante explorar una mejor interpretación de los mecanismos de lixiviación de calcopirita, porque abre la oportunidad de desarrollar nuevos procesos más eficientes de extracción de Cu.
Electro-catálisis y lixiviación de calcopirita
La lixiviación oxidante de calcopirita con iones Fe³⁺ en medio ácido, ocurre por mecanismos electroquímicos bien conocidos (potencial mixto), donde se combina la oxidación anódica del mineral:

Con la reducción catódica del ion Fe³⁺:

Dando como reacción global, la siguiente expresión:

Sin embargo, como ya se dijo, esta es una reacción de cinética lenta.
Sin embargo, analizada bajo el concepto de electro-catálisis es posible aumentar la velocidad de la reacción mediante catalizadores adecuados.
Los catalizadores se caracterizan por actuar en pequeñas concentraciones, y porque no se consumen en el proceso, dado que se regeneran como parte del mecanismo de reacción.
Si las reacciones son electroquímicas, el proceso depende de reacciones de oxidación o reducción, con una activa transferencia de electrones, y es ahí justamente donde el catalizador redox desempeña su rol.
Se trataría de catalizadores capaces de aumentar la velocidad de una reacción electroquímica, disminuyendo su energía de activación.
Lixiviación yodurada de calcopirita
La lixiviación yodurada de calcopirita es actualmente una opción promisoria para la extracción de Cu desde minerales primarios.
Técnicamente consiste en aumentar la velocidad de la reacción de lixiviación férrica, mediante el empleo de ion yoduro.
El proceso requiere la adición de pequeñas concentraciones de ion ioduro (I⁻) en la forma de KI, en presencia de sulfato férrico, a temperatura ambiente y a presión atmosférica (proceso patentado por JX Nippon Mining and Metals Corporation, Manabe 2012).
Algunas reacciones importantes que involucran la estabilidad química del ion yoduro, se muestran a continuación:

El yodo (I₂(aq)) en medio yoduro tiene manifiesta tendencia a formar ion tri-yoduro (I₃⁻).

El mecanismo de la lixiviación yodurada consiste en la oxidación del ion ioduro (I⁻) por iones férricos para formar iones tri-yoduro (I₃⁻), y/o yodo (I₂). Las reacciones químicas son las siguientes:

Lo importante, es que, el ion tri-yoduro y el yodo son efectivos oxidantes y lixiviantes de calcopirita, cuyo mecanismo de disolución se muestra en las siguientes reacciones:

Simultáneamente, en presencia de oxígeno, el ion Fe³⁺ se regenera por oxidación del ion Fe²⁺.

Como se aprecia, se trata de una cadena de reacciones que conforman un ciclo virtuoso. Una vez regenerado el ion Fe³⁺, el ciclo de oxidación catalítica se reactiva, y solo requerirá para continuar, un flujo de aire inyectado permanentemente al sistema.
En definitiva, los agentes oxidantes primarios serían el ion Fe³⁺ y el oxígeno del aire (O₂). En cambio, el ion yoduro sería el catalizador (cuplas: (I⁻/I₂) y (I⁻/I₃⁻)). Las especies intermedios que participan en la transferencia de electrones serían los iones tri-yoduro (I₃⁻) y/o yodo molecular (I₂).
Termodinámicamente, el ion Fe³⁺ es un oxidante más fuerte que el ion yoduro (I⁻), por lo cual la mayor extracción de Cu conseguida con ion yoduro, necesariamente se explica por un aumento en la cinética de reacción.
Las variables claves son la concentración de ion yoduro, el potencial Eh, y la temperatura.
Cabe destacar que, en este caso, la capa de azufre elemental formada sobre las partículas, no inhibe la reacción de disolución de la calcopirita.
En la práctica, el pH de la solución férrica se debe ajustar a valores entre 1.4 – 1.8; y el de la solución de I⁻ a pH 1.8, mediante adición de ácido sulfúrico.
Durante el proceso de lixiviación, el pH de irrigación se debe controlar para mantener estable la concentración de Fe total en el PLS. Cuando esta excede la concentración de Fe total de la solución de alimentación (5g/L de ion Fe³⁺), se debe aumentar el pH de la solución de alimentación; y lo contrario se recomienda si la concentración de Fe³⁺ se reduce. Por lo tanto, se requiere la adición o remoción de ion Fe³⁺ para controlar el proceso.
Un ejemplo del aumento de extracción de Cu mediante lixiviación yodurada se presenta en la Figura 1.

Figura 1. Efecto de la concentración de ioduro sobre la cinética de extracción de Cu desde calcopirita a 25°C (columnas de 1m) (Winarko et al., 2023).
Durante la etapa de riego, es factible implementar una estrategia de lixiviación en dos etapas. En la primera etapa la solución de riego estaría formada solo por ácido sulfúrico e ion Fe³⁺, condición bajo la cual se lixivian las especies del tipo óxidos de Cu y sulfuros secundarios. En una segunda etapa, se puede cambiar a una solución con ion Fe³⁺ más ion yoduro, con el propósito de lixiviar la calcopirita remanente.
Resultados de esta estrategia se muestran en la Figura 2.

Figura 2. Extracción de Cu en columnas de 6 m, con irrigación de ion yoduro (Fukano and Miura, 2021).
La otra variable importante es el potencial Eh. La cinética de disolución de Cu aumenta con el potencial de la solución, en el rango de 669 a 769 mV vs. SHE (potenciales referidos al electrodo estándar de hidrógeno) (Fig. 3).
El proceso requiere un potencial oxidante (>740 mV SHE) para que el ion tri-yoduro y yodo molecular, formadas por oxidación del ion yoduro con ion Fe³⁺, se mantengan estables en el sistema, permitiendo su reacción con la calcopirita (ver Figura 3).

Figura 3. Extracción de Cu por lixiviación de calcopirita asistida por ioduro a distintos potenciales, 150 mg/L iodo total y 25°C (Winarko et al., 2022).
Por otro lado, como reacciones laterales, sobre la superficie de la calcopirita se forma Jarosita (KFe³(SO₄) (OH)₆), y azufre elemental (S⁰). Sin embargo, por ser una capa porosa, la reacción de disolución no se detiene.
La reacción de formación de Jarosita es la siguiente:
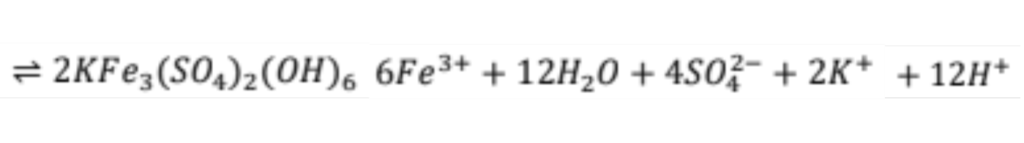
Finalmente, durante el proceso pueden ocurrir pérdidas de ion yoduro, ya sea por volatilización o por precipitación de yoduro cuproso (CuI).
Por otro lado, es oportuno mencionar que la lixiviación clorurada de calcopirita es otro ejemplo de lixiviación catalítica, solo que en este caso los catalizadores serían el complejo clorurado cúprico (CuCl⁺) y el complejo clorurado férrico (FeCl²⁺) (Newsletter N°1).
El oxígeno del aire inyectado al sistema, oxida los complejos clorurados cuprosos y ferrosos, regenerando los catalizadores y reactivando el ciclo de catálisis.
El futuro de la tecnología de lixiviación de minerales primarios, y también de concentrados ricos en calcopirita, dependerá del avance que se consiga en el desarrollo de nuevos catalizadores. Estos deberán ser más efectivos y/o más baratos.
Se ha hecho referencia a dos procesos tecnológicos de lixiviación, como la lixiviación yodurada y la lixiviación clorurada, los cuales pueden ser clasificados en forma más general, como lixiviación catalítica de calcopirita.
El perfeccionamiento de los catalizadores ya identificados, o el desarrollo de nuevos catalizadores hará posible lixiviar minerales primarios de Cu en ciclos más cortos y con mayor rendimiento en extracción de Cu.
Finalmente, se destaca la importancia del oxígeno (o productos que generen oxígeno), tanto en mantener la concentración de los oxidantes requeridos por la reacción de lixiviación oxidante de calcopirita, como en regenerar el catalizador.
Referencias:
- Manabe, M., 2012. Method of leaching copper sulfide ore with the use of iodine. US Patent 8,163,063 B2.
- Winarko, J., et al., 2022. Iodine-assisted chalcopyrite leaching in ferric sulfate media: Kinetic study under fully controlled redox potential and pH. Hydrometallurgy, 208, 105797.
- Winarko, J., et al., 2023. Modelling the scale-up of the iodine-assisted chalcopyrite leaching in ferric sulfate media from reactors to columns and simulating heap operations. Hydrometallurgy, 222, 106203.
- Fukano, Y. and Miura, A., 2021. Chalcopyrite leaching with iodine (JX Iodine Process) for various ore types. Hydrometallurgy, 206, 105752.






